Von RUO zu GMP
Die Entwicklung einer Therapieanwendung ist komplex: Sie beginnt als Idee in der Forschung und Entwicklung und durchläuft präklinische und klinische Studien, bis die Marktzulassung und Vermarktung erreicht sind. Während dieses Prozesses ist die Umstellung von RUO zu GMP eine Qualitätsnotwendigkeit, aber es ist schwierig, Schlüsselparameter wie Rohstoffe zu ändern, wenn ein dokumentierter Prozess bereits etabliert ist. Daher ist es ratsam, so früh wie möglich umzustellen, um Kosten zu optimieren und wertvolle Zeit zu sparen. Diese Umstellung ist entscheidend, um die Sicherheit und Wirksamkeit des Produkts zu gewährleisten, die behördlichen Anforderungen zu erfüllen und schließlich die Marktzulassung zu erhalten. Wir unterstützen Sie bei der Entwicklung von der Forschung bis zur Kommerzialisierung mit unseren Nährmedien, Reagenzien und Pufferlösungen, die mit drei perfekt abgestimmten Qualitätsstufen einen nahtlosen Übergang ermöglichen.
Erfahren Sie mehr über den Prozess in unserem interaktiven Diagramm.

Forschung Entwicklung
Während der Forschungs- und Entwicklungsphase wird eine geeignete Therapieanwendung identifiziert. Rohstoffe werden in der Regel in Research Use Only (RUO) Qualität verwendet.
Präklinische Entwicklung
Während der präklinischen Entwicklung wird der Therapiekandidat in In-vitro- und In-vivo-Experimenten getestet, um erste Daten über seine Leistungsfähigkeit zu gewinnen. Diese Informationen sind nützlich für die Planung von Studien der klinischen Phase.
Klinische Entwicklung
Die klinische Entwicklung kann in drei separate Phasen unterteilt werden:
- Phase l: Die ersten Studien umfassen eine kleine Anzahl von hauptsächlich gesunden Teilnehmern oder Patienten, um die Auswirkungen der Behandlung beim Menschen zu untersuchen.
- Phase II: Anschließend wird die Sicherheit und Wirksamkeit des Medikaments bei einer Krankheit an Patienten getestet.
- Phase III: Es werden mehr Daten über die Sicherheit, den Nutzen und die Wirksamkeit des Produkts bei einer noch größeren Anzahl von Patienten als in den vorherigen Phasen gesammelt.
Kommerzialisierung
Nach erfolgreichen klinischen Phasen I - III kann das Medikament zur Marktzulassung eingereicht werden. Nach erfolgreicher Marktzulassung
wird die Produktion in großem Maßstab aufgenommen.
Katalogprodukte
Die Entwicklung neuer therapeutischer Anwendungen erfordert umfangreiche Forschung. Bei PAN können Sie aus mehr als 1.800 Katalogprodukten in RUO-Qualität wählen, darunter eine große Auswahl an Kulturmedien, Reagenzien und Pufferlösungen. Wir haben 85 % unseres Sortiments auf Lager und sind innerhalb von 1-2 Tagen lieferbereit.
Kundenspezifische Produkte
Der Übergang von RUO zu GMP wird durch GMP ready-Versionen unserer RUO-Produkte erleichtert, die ideal für das Upscaling und die Validierung Ihrer Anwendung geeignet sind. Zu diesem Zeitpunkt verwenden Sie bereits Produkte, die in Bezug auf die Qualität der Rohstoffe und die Produktionsverfahren unseren GMP-Produkten entsprechen. Sie werden lediglich weniger Qualitätsprüfungen unterzogen. Daher bieten sie ein optimales Kosten-Nutzen-Verhältnis mit geringeren Kosten im Vergleich zu unseren GMP-konformen Produkten.
Klinische Lösungen
Für klinische Studien und die kommerzielle Herstellung sind unsere Medien, Reagenzien und Pufferlösungen in GMP-Qualität erhältlich, um die Einhaltung gesetzlicher Vorschriften zu gewährleisten und die höchsten medizinischen Qualitätsstandards zu erfüllen.

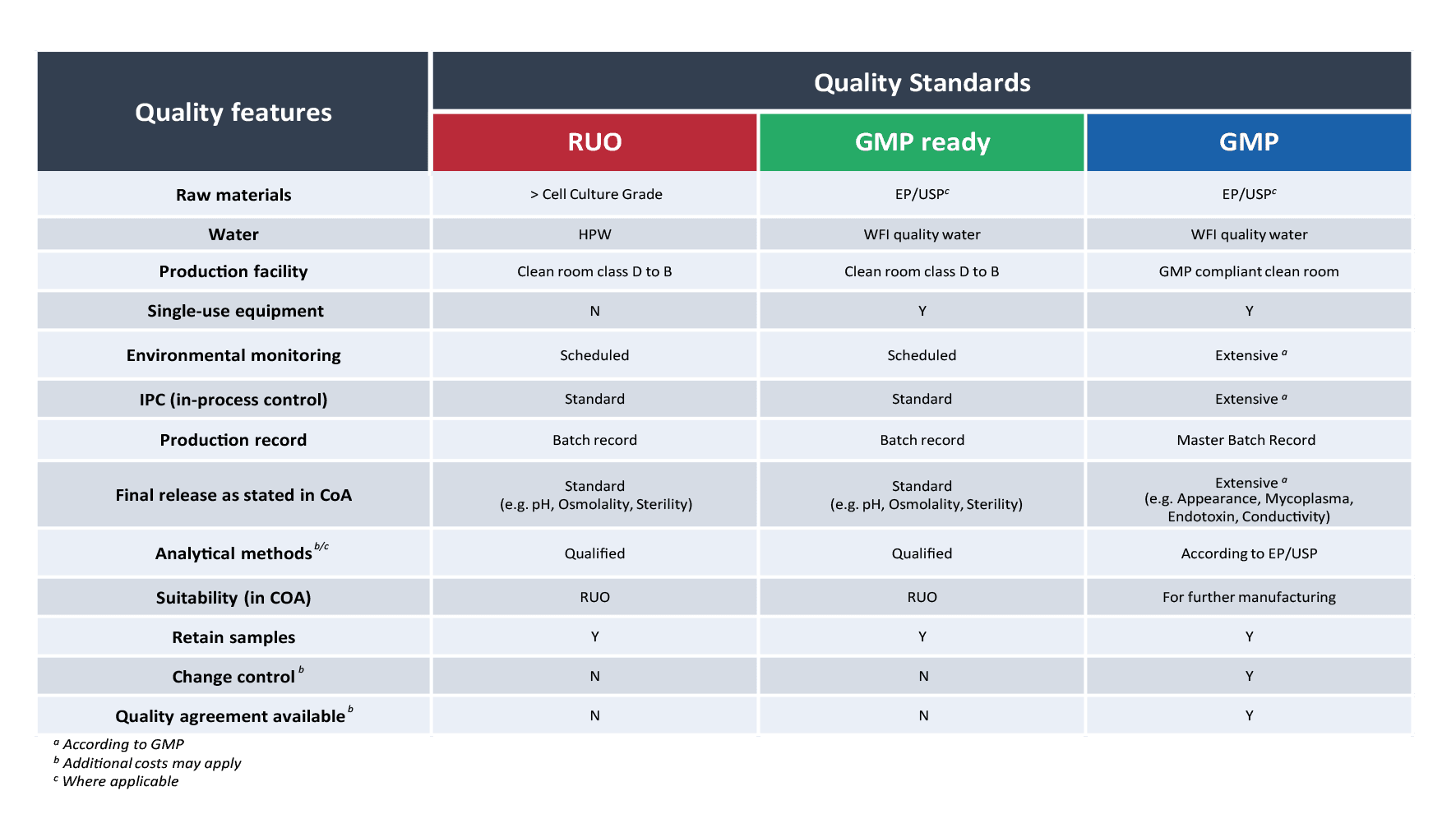
RUO – Qualitätsmerkmale
RUO-Produkte von PAN-Biotech sind durch ein rotes Etikett gekennzeichnet. Wir bieten in unserem Katalog eine breite Palette von RUO-Produkten an, die von Kulturmedien und Reagenzien bis hin zu Pufferlösungen reicht. Sie eignen sich hervorragend für die Forschungs- und Entwicklungsphase von neuen Therapieanwendungen. Mehr als 1.800 Katalogprodukte sind verfügbar, 85% davon auf Lager und innerhalb von 1-2 Tagen lieferbar.
GMP ready – Qualitätsmerkmale
Der Wechsel von RUO zu GMP wird durch unsere GMP ready Produkte erleichtert, die durch ein grünes Etikett gekennzeichnet sind. Diese Produkte unterscheiden sich deutlich von unseren RUO-Qualitätsprodukten. Die Qualität der im Produktionsprozess verwendeten Rohstoffe entspricht bereits dem Europäischen Arzneibuch (EP) und dem US-Amerikanischen Arzneibuch (USP), genau wie bei unseren GMP-Produkten. Dies macht sie ideal für das Upscaling und die Validierung Ihrer Produkte für den klinischen und industriellen Maßstab.

GMP – Qualitätsmerkmale
Unsere Produkte in GMP-Qualität, zu erkennen an ihrem blauen Etikett, bieten den höchstmöglichen Qualitätsstandard für Zellkulturmedien, Reagenzien und Pufferlösungen. Sie werden gemäß EU GMP Anhang 1 hergestellt und gewährleisten die Einhaltung von Vorschriften durch etablierte Prozesse wie umfassende Umgebungsüberwachung, Inprozesskontrollen (IPC) und Master Batch Records. Daher eignen sich unsere Produkte in GMP-Qualität für den Einsatz in klinischen Studien und für die kommerzielle Herstellung.
GMP-Produktion bei PAN-Biotech
Unsere Produkte spielen eine entscheidende Rolle in verschiedenen biowissenschaftlichen Anwendungen, einschließlich Arzneimitteln für neuartige Therapien (ATMPs), Biopharmazeutika, Gen- und Zelltherapien, Impfstoffherstellung und mehr. Ob Sie Nährmedien für Zelltherapiezwecke, Reagenzien oder Puffer für die Bioprozessierung benötigen, wir liefern Ihnen gebrauchsfertige Lösungen für Ihre GMP-Anwendungen. Diese Produkte werden in unserer neuen GMP-konformen Produktionsanlage unter strenger Qualitätskontrolle hergestellt.
GMP-Anlage:
Unsere neue Produktionsanlage, die seit 2022 in Betrieb ist, wurde gemäß EU-GMP Anhang 1 für sterile Arzneimittel gebaut und qualifiziert. Ihr hochmodernes Design ermöglicht eine schnelle, flexible und skalierbare Produktion Ihrer Produkte in GMP-Qualität, die von unserem qualifizierten und hervorragend ausgebildeten Personal durchgeführt wird.
Die wichtigsten Fakten:
- Dedizierte, tierfreie Anlage
- Reinraumklassen D bis A
- 1.000.000 L Abfüllkapazität pro Jahr
- Chargengrößen bis 1.000 L
- Sterile Abfüllung von 50 ml Röhrchen bis zu 1000 L Bags
- Single-Use Equipment
- Umgebungsüberwachung gemäß GMP-Richtlinien
- Etablierte Prozesse für kundenspezifische Produktionen


Die wichtigsten Fakten:
- Dedizierte, tierfreie Anlage
- Reinraumklassen D bis A
- 1.000.000 L Abfüllkapazität pro Jahr
- Chargengrößen bis 1.000 L
- Sterile Abfüllung von 50 ml Röhrchen bis zu 1000 L Bags
- Single-Use Equipment
- Umgebungsüberwachung gemäß GMP-Richtlinien
- Etablierte Prozesse für kundenspezifische Produktionen

Qualitätsmanagement:
Die Einhaltung der GMP kann nur mit einem angemessenen Qualitätsmanagementsystem (QMS) erreicht werden. Unser QMS ist nach ISO 9001 und ISO 13485 (IVDR-Produkte) zertifiziert. Wir setzen die Prinzipien der GMP um und garantieren sichere und zuverlässige Herstellungsprozesse.
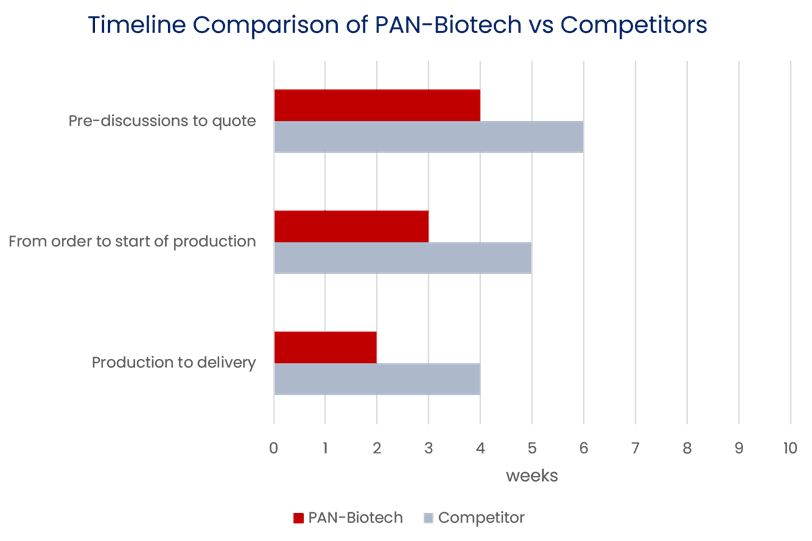
Fallstudie: Schnelle Abwicklung einer GMP-Produktion
Im Oktober wurden wir von einem Impfstoffhersteller mit einer Anfrage für eine schnelle Produktion kontaktiert. PAN-Biotech hat erfolgreich schnelle kundenspezifische Prozesse etabliert und optimiert. So konnten wir schnell feststellen, inwieweit eine schnelle Produktion im Vergleich zu unseren Wettbewerbern möglich war. Innerhalb von 3 Tagen konnten wir ein überzeugendes Angebot unterbreiten und am 16. November erhielten wir den ersten Auftrag, der am 8. Dezember, nur 3 Wochen später, zur ersten Produktion führte. Wir konnten unsere erste Lieferung in weniger als zwei Wochen am 20. Dezember durchführen. Insgesamt haben wir die Produktion von 50.000 Litern in weniger als 5 Wochen am 10. Januar erfolgreich abgeschlossen.
Einen detaillierten Vergleich zwischen den Qualitätsstufen unserer Produkte finden Sie in der untenstehenden Tabelle: